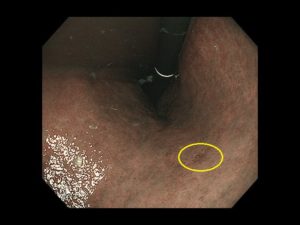
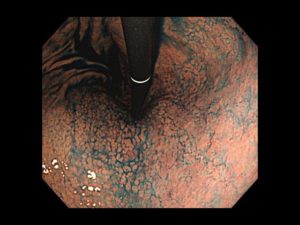
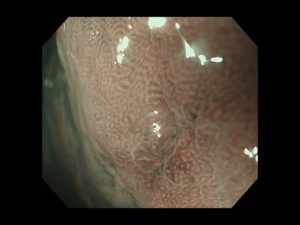
十二指腸腺腫/十二指腸がん①(胃内視鏡/胃カメラ)
十二指腸は、胃と小腸をつなぐ短い臓器で、同部に発生する十二指腸上皮性腫瘍(がん、腺腫)は、内視鏡検査で約0.03~0.5%程度の確率で発見されます(乳頭部腫瘍は除く)。組織型は、大きく腸型、胃型、Brunner 腺腫に分けられますが、腸型の頻度が多いのが特徴です。
十二指腸の上皮性腫瘍は、十二指腸腺腫と十二指腸がんに分けられ、腺腫は良性病変ですが、がんに進展する潜在性を持っています。がん研究会のデータでは20mm以上の大きさの病変や、生検で高異型度腺腫と診断されたものは、進展リスクが高いか、あるいは既に腺腫内がんとなっている可能性が高いことが示されています(Okada et al. Am J Gastoenterol 106:357-64)。
腺腫やがんの治療法は、胃や大腸の腫瘍と同様に、早期のもので転移リスクがないと判断されれば、内視鏡での切除が望ましいところですが、十二指腸は他の臓器に比べて腸管壁が薄い上に、内視鏡の操作性が悪く、胆汁や膵液など切除後潰瘍に影響する消化液が分泌される臓器でもあるため、治療による偶発症がおきやすく、患者さんの状態と各治療の利益/不利益を総合的に考量して治療方針が決められます。
内視鏡治療については、最近、従来のEMRやESDという切除以外に以外にも、腸管壁のダメージが少ない切除法であるコールドポリペクトミーが採用されたり、特殊な器具(OTSC)や人工シートを用いた創閉鎖技術が登場したりしており、少しずつ偶発症に対する克服がなされています。内視鏡治療が難しい場合には、内視鏡・腹腔鏡の合同手術(LECS)を含めた外科手術が考慮されます。
咽頭がん②(胃内視鏡/胃カメラ)
咽頭がんの存在診断は、内視鏡の画像診断と細胞の組織検査により行われますが、深くまで浸潤していることが疑われる場合、腫瘍の広がりの検査をするためにCT、MRI、表在超音波などの検査をし、進展範囲やリンパ節転移の有無を調べていきます。そして、腫瘍の大きさ(T)、頚部リンパ節転移の大きさや数(N)、肺や骨などへの転移(M)などをチェックして、それに応じて、がんの進行度が、第Ⅰ期からⅣ期の4段階に分けられます。通常第Ⅰ期・Ⅱ期を早期がん、第Ⅲ期・Ⅳ期を進行がんと位置付けられています。
がんが比較的限局していて、リンパ節転移がない(もしくはそのリスクが少ないと見積もられる)場合には、比較的侵襲の少ない内視鏡治療(EMR、ESD)のみで治癒切除が期待できます。ただし、状態によっては、放射線治療が選択される場合もあります。
それよりも進行した例では、耳鼻科、頭頸科による手術や放射線化学療法などを組み合わせた治療が選択されます。
咽頭、特に下咽頭は、嚥下(飲み込み)に関わる重要な機能をもっているため、治療に際しては、いかに機能を温存し、生活の質を保つことができるかが重要になってきます。しかし、下咽頭の近くには、発声に関わる喉頭(声帯)も位置しているうえ、見つかったときには進行がんになってしまっている例が圧倒的に多いことから、機能を犠牲にせざるを得ない場合が多いのが現状です。そして、咽頭がんの中で、下咽頭がんが最も予後が悪いとされています。
当院では、5mm程度以下の下咽頭がんの発見に長けており、無症状の段階でそれらを発見する経験と能力を有しております。飲酒、喫煙などの危険因子があり、前記した症状がある方は、上部内視鏡検査をおすすめします。
咽頭がん①(胃内視鏡/胃カメラ)
咽頭とは鼻の奥から食道に至るまでの食物や空気の通り道です。
このうち、中咽頭から下咽頭ににできるがんの発生には、喫煙・飲酒と強い関連があります。
食道がんも、喫煙・飲酒が危険因子であり、咽頭がんの危険因子と共通していますが、実際に咽頭がんは、食道がんの方の10%近くに合併しており(field cancerization)、特に、アセトアルデヒド脱水素酵素やアルコール脱水素酵素の活性が低下している場合(アルコール摂取で顔が赤くなるような方)、よりリスクが高いとされています。
初期のうちは自覚症状がないことがほとんどで、内視鏡で偶然に発見されることが多いのですが、進行すると、飲み込むときの違和感、咽頭痛、吐血(出血)、口を大きく開けにくい、舌を動かしにくい、声の変化などの症状がでる場合があります。増大するにつれて、頸部リンパ節に転移したり、表層を進展して喉頭まで広がっていくこともあります。
上記症状が気になる場合には、早めの内視鏡検査を受けることが大切です。
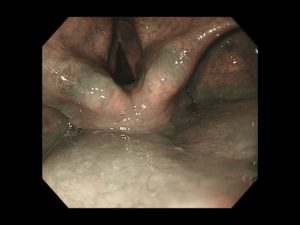
咽頭がんは、食道がんと同様に、早期発見されれば、内視鏡治療だけで治癒します。
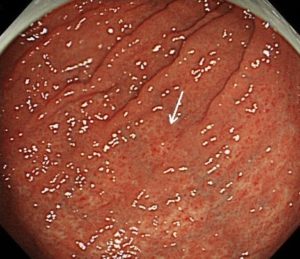
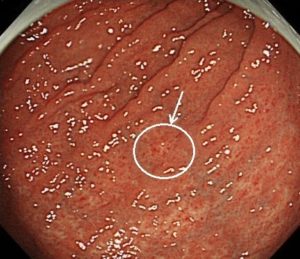
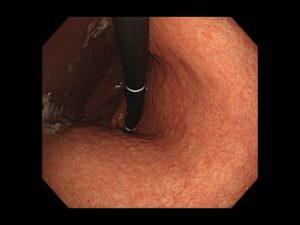
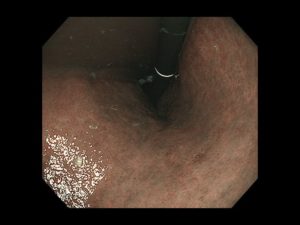
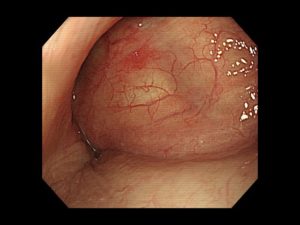
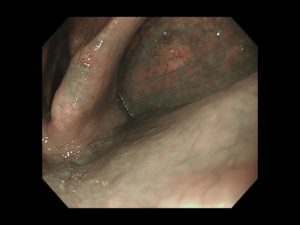
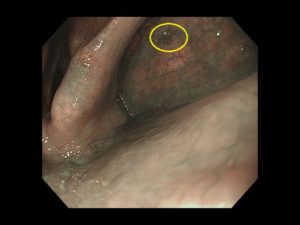
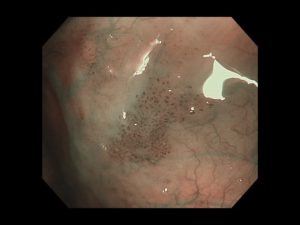
写真は、院長が発見した、右下咽頭梨状陥凹側壁の微小咽頭がん(<5mm)です。内視鏡治療のみで治癒が得られています。
機能性腹痛症候群/FAPS(胃内視鏡/胃カメラ)
機能性腹痛症候群(functional abdominal pain syndrome:FAPS)は、各種検査(画像・採血)でこれといった異常が検知されない機能性消化管障害(functional gastrointestinal disorders:FGID)でありながら、症状はむしろ消化管機能との関連性が乏しい、慢性の腹痛をきたす疾患です。うつや不安障害などの精神疾患を合併し、生活の質が障害されている症例が多いとされており、経験則からもそのような印象が持たれます。診断基準は以下の通りです。
機能性腹痛症候群の診断基準
以下の全ての項目があてはまること
1 持続性あるいはほぼ持続性の腹痛
2 痛みと生理的現象(摂食,排便,月経)との関連はないか,あったとしても稀である
3 日常生活に何らかの障害がある
4 痛みは嘘(詐病)ではない
5 痛みを説明するような他の機能性消化管障害の診断基準にあてはまらない
※6 カ月以上前から症状があり,最近 3 カ月は上記の基準を満たしていること
病態としては、神経障害性疼痛に効果を示す、低用量の三環系抗うつ薬が、時に痛みに効果的である場合があることから、神経性障害と考えられており、末梢神経と中枢神経の両方で内臓知覚過敏が起きていることも知られています。治療は、前記した三環系抗うつ薬の他、認知行動療法などがありますが、一般的な内科医だけで、この疾患を治療していくのは難しい場合が多いため、心療内科や精神科と共同して治療にあたる場合が一般的です。
院長 岡田 和久
除菌後胃癌④(胃内視鏡/胃カメラ)
論文要旨の解説を致します。
背景
ピロリ菌現感染で胃がん治療された方は、その後の除菌治療により異時多発(胃内の胃癌がん再発)が抑制されることが既報により示されていますが、除菌後に発生した胃がんの異時多発の頻度については、これまで報告がありませんでした。本邦では除菌治療が保険収載されており、今後は除菌後胃がんが増加していくと思われます。そのため、ピロリ菌現感染胃がんと、除菌後胃がんの方の生物学的・腫瘍学的な振る舞いの差を確認することは、胃がんで治療された方のフォローアップ方法を検討する上で、臨床的に必要な情報でした。
方法
内視鏡治療で治癒切除が得られた早期胃がんの方で、治療後2年以上、内視鏡による経過観察をされた方を、①除菌後1年以上経過してから胃がんが発見された群180名と、②現感染で胃がんが発見された群602名の2群に分けて、その後の異時多発に差があるかを、後ろ向きに解析をしました(詳しい患者選択条件は割愛します)。解析にあたり、選択バイアスを最小化するために傾向スコア分析及びIPTW分析を用いました。
結果
傾向スコア分析において2群の異時多発の頻度は統計学的に有意差がなく、IPTW法によっても同様の結果でした。また、除菌後5年未満だった例を除外して解析し直してもなお、結果は同様でした。COX比例ハザード解析では、年齢、分化型がん、初期多発が異時多発の危険因子として抽出され、この結果は既報とほぼ同様であったことから、本結果の頑健性が示されました。
結論
以上の結果から、除菌後胃がんの内視鏡治療後における経過観察は、ピロリ菌現感染治療後のそれと同等程度が望ましいと考えられました。
以上
除菌後胃癌③(胃内視鏡/胃カメラ)
除菌後胃癌に関して、院長が筆頭著者である論文 “Incidence of metachronous gastric cancer in patients whose primary gastric neoplasms were discovered after Helicobacter pylori eradication”が、GIE誌(impact factor 7.204)に掲載されます。
要旨は以下になります。次回、内容をご説明致します。
BACKGROUND AND AIMS:
The incidence of metachronous gastric cancer (MGC) in patients whose primary gastric neoplasm is discovered after Helicobacter pylori (H pylori) eradication remains unclear. Here, we evaluated the long-term effect of previous H pylori eradication on development of MGC after endoscopic submucosal dissection (ESD).
METHODS:
We analyzed prospectively collected data of consecutive patients with successful H pylori eradication more than 1 year before (eradicated group; 180 patients), or after (control group; 602 patients) initial curative endoscopic submucosal dissection (ESD). These patients were also followed by endoscopy for over 2 years. Propensity score matching and inverse probability of treatment weighting (IPTW) were used in order to adjust for confounding variables during data analysis. The main outcome was the incidence of MGC after initial ESD.
RESULTS:
In a propensity-matched analysis of 174 pairs, the incidence of MGC was similar in the two cohorts (33.9 per 1,000 person-years vs 40.8 per 1,000 person-years in the control group, P = 0.454) at a median follow-up of 4.1 years (IQR, 3.0-5.6 years). Incidences were also similar in the 2 groups when data were analyzed using IPTW, even after exclusion of 123 patients with successful H pylori eradication <5 years before initial ESD. Multiple Cox regression analysis revealed age, differentiated-type histology and initial multiplicity were predictors of MGC in patients after initial curative ESD.
CONCLUSIONS:
The frequency of follow-up surveillance after initial curative ESD should be kept constant, irrespective of whether H pylori eradication is performed before or after initial curative ESD.
除菌後胃癌②(胃内視鏡/胃カメラ)
ピロリ菌の除菌後も、胃がんは年率0.1~0.3%程度発生します。このため、定期的な上部内視鏡検査(胃カメラ)が推奨されています。
しかし、同じピロリ菌感染による慢性胃炎でも、胃がんの発生リスクは、人によって異なっています。たとえば、男性の方や、胃粘膜が高度に萎縮している方(ピロリ菌による胃炎の影響を強く受けている方)、胃がん(胃腺腫)の既往のある方、喫煙歴のある方などでは、それ以外の方と比べて、胃がん発生のリスクがより高いと報告されています。
そして最近では、ピロリ菌除菌後における背景胃粘膜の「DNAメチル化レベル」が、胃の発がんリスクと関連するのではないかと注目されており、多施設の前向き試験が行われています。
胃がんをはじめとする、様々な臓器のがんでは、細胞の無秩序な増殖を抑える役割を持った「がん抑制遺伝子」が、突然変異や、メチル化と呼ばれる修飾をうけるなどして不活性化され、がんが発生、成長しています。胃においては、このメチル化が、がんの部分だけでなく、一見正常に見える胃の粘膜でも、色々な遺伝子に蓄積しており、その蓄積の程度と、胃がんの発生リスクが相関していることが、優れた研究により示されています。
将来的に、メチル化レベルの測定がより簡便で安価になれば、リスクに応じた上部内視鏡の頻度・間隔の設定ができるのではないかと期待されています。
除菌後胃癌①(胃内視鏡/胃カメラ)
日本では2013年2月よりピロリ菌に対する慢性胃炎の除菌が保険適用になり、除菌治療が推奨されています。
ピロリ菌の除菌治療をすると、その後の胃がん発生率は38~47%減少するとされ、胃がんの治療後であっても、胃内再発(異時多発)の頻度が33~50%程度減少するとされています。
しかし、逆に言えば、ピロリ菌の除菌が成功しても、胃がんの発生率は半分以下にはなりません。
加えて、除菌後に発見された胃がんは、「胃炎様」であることが多く、がんの表面を、正常な非がん上皮(正常な胃粘膜)が覆ったり、あるいは異型度の低い上皮(ELA)がモザイクに混在しており、非常に発見しづらくなっています。しかも、サイズが小さく、平坦もしくは陥凹型が多いという特徴があります。
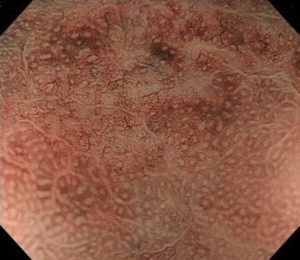
写真は、院長が発見した、3mm大の除菌後胃癌です。
通常の内視鏡では病変部位がわかりづらいですが、NBI拡大観察をすると、領域をもった構造異型が確認でき、「微小がん」と診断できます。
スキルス胃がんとは③(胃内視鏡/胃カメラ)
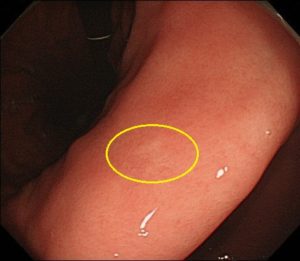
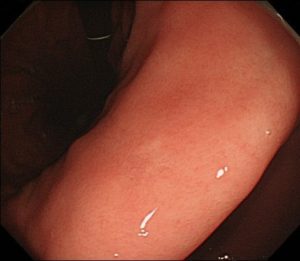
 この症例も、院長が発見した未分化型早期胃がんで、学会/論文発表に使用した症例です。
この症例も、院長が発見した未分化型早期胃がんで、学会/論文発表に使用した症例です。
40代女性で、大きさ4mm大の、ピロリ菌陰性(ピロリ菌の感染がない)の方の、未分化型早期胃がんです。
内視鏡治療で治癒切除が得られました。
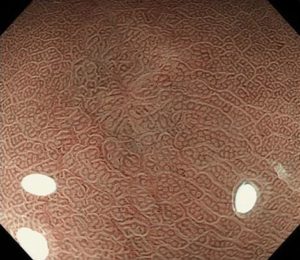
粘膜面の褪色変化で指摘できる病変で、NBI拡大観察(茶色と緑の写真)では、窩間部開大所見が認識され、良性変化である限局性萎縮のNBI拡大所見とは異なっています。このNBI所見から、ごくごく早期の未分化早期胃がんと診断できます。
このような症例は、バリウム検査や経鼻内視鏡では診断しきれず、経口のNBI併用拡大内視鏡を使用しなければ、その場での診断が不可能な病変です。
スキルス胃がんも、上記病変のような、ごく早期に発見できれば、生命に影響を及ぼさないうちに治癒切除させることができます。
スキルス胃がんとは②(胃内視鏡/胃カメラ)
前記しましたように、スキルス胃がんの多くは、未分化型早期胃がんからの進展ですが、発見するのが難しいのが現状です。特に、背景粘膜の炎症や萎縮程度が強い場合、早期病変の視認はさらに困難となります。
写真の例は、院長が発見した未分化型早期胃がんで、学会総会と英論文で発表/提示した症例です。
この症例は、大きさ8mm程度で、深達度が浅く、結果的に内視鏡治療のみで治癒切除が得られました。病変は、背景の炎症が強く、通常観察からは視認することが非常に難しい病変です。実際、内視鏡学会総会での発表時には、この病変のNBI拡大像(緑・茶色のアップの写真)に関する発表を行いましたが、
フロアの多くの先生方から、この病変はそもそも通常観察で存在を指摘することすらできないと意見されました。
このような胃がんは、比較的まれな胃炎様の未分化型胃がんですが、1年で数百という胃がんを取り扱っている、がん専門病院の専門医でないと、発見するのが非常に難しい病変です。