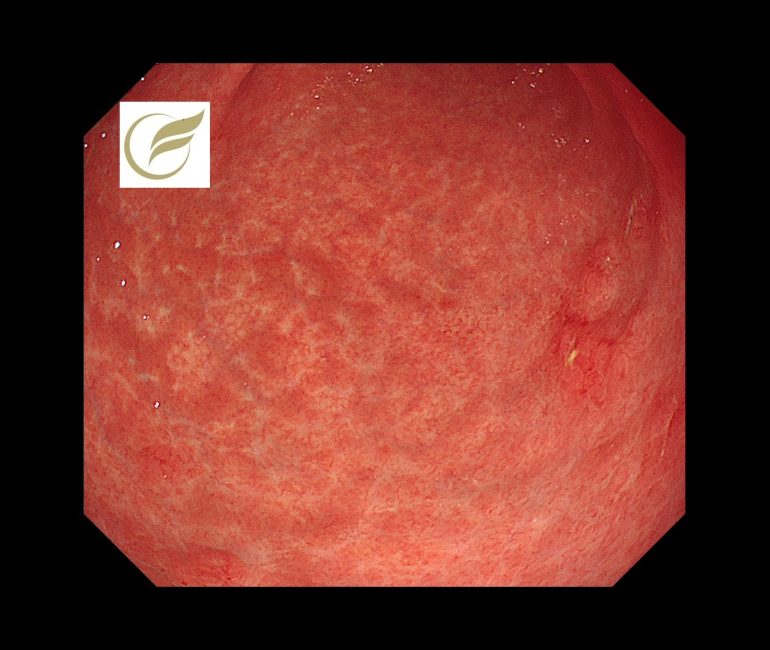
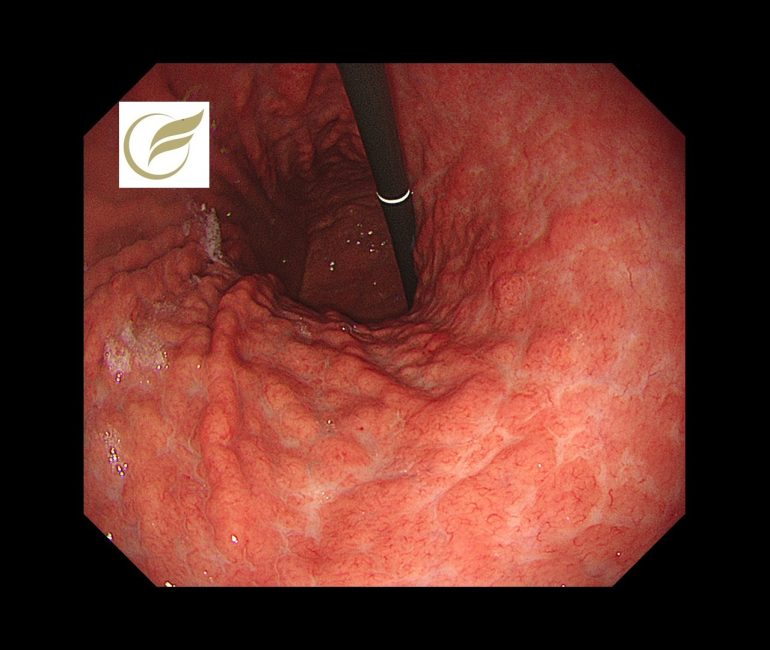
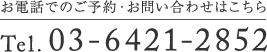汎胃炎④(胃内視鏡/胃カメラ)
胃MALTリンパ腫では、腫瘤形成に乏しく、胃全体にびまん性炎症様変化を呈することがあり、このようなタイプは汎胃炎類似型(pangastritis-like appearance)に分類されます(1)(2)(3)。
内視鏡的には、胃全体の発赤、浮腫、顆粒状変化、白苔付着などを示し(3)(4)、明らかな潰瘍や隆起を欠きH. pylori関連慢性胃炎との鑑別が困難な場合があります(2)(3)。
背景にHelicobacter pylori感染を伴う症例が多く、炎症性変化が前景に立つことが特徴です(2)(5)。
病変が多発・びまん性ではあるものの、限局的な狙撃生検のみでは診断に至らないことがあるため、胃全体からの多点・広範囲生検が診断上重要とされています(7)。
治療は、限局期においてはH. pylori除菌により内視鏡像および病理所見が改善・消失する症例が多いとされています(2)(5)。
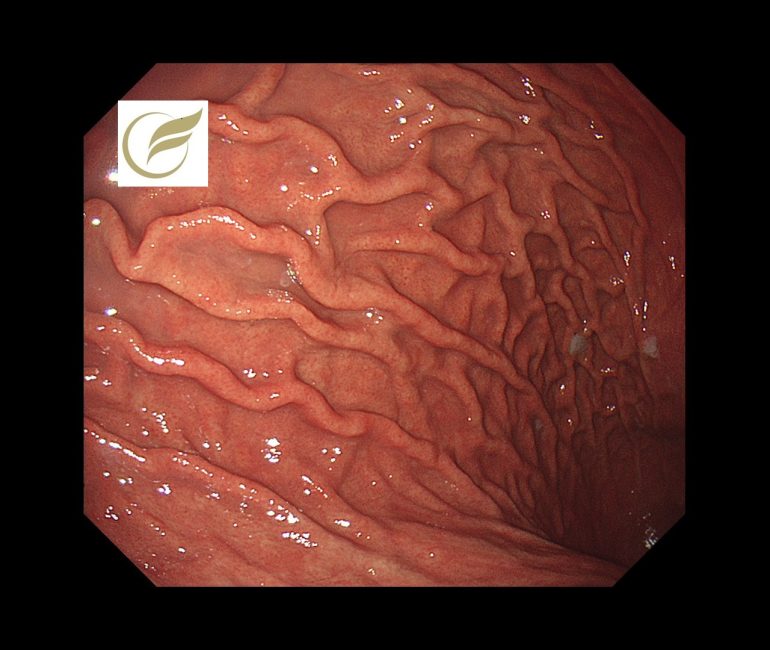
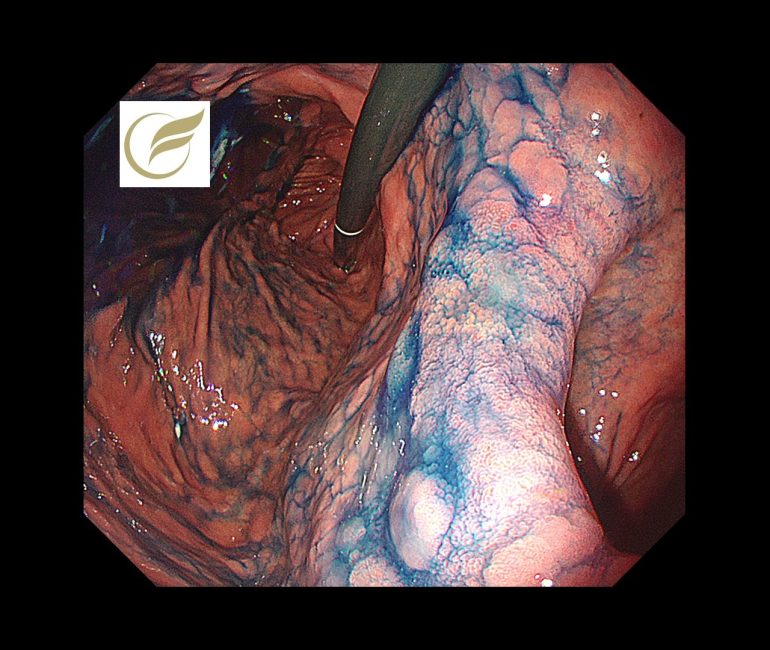
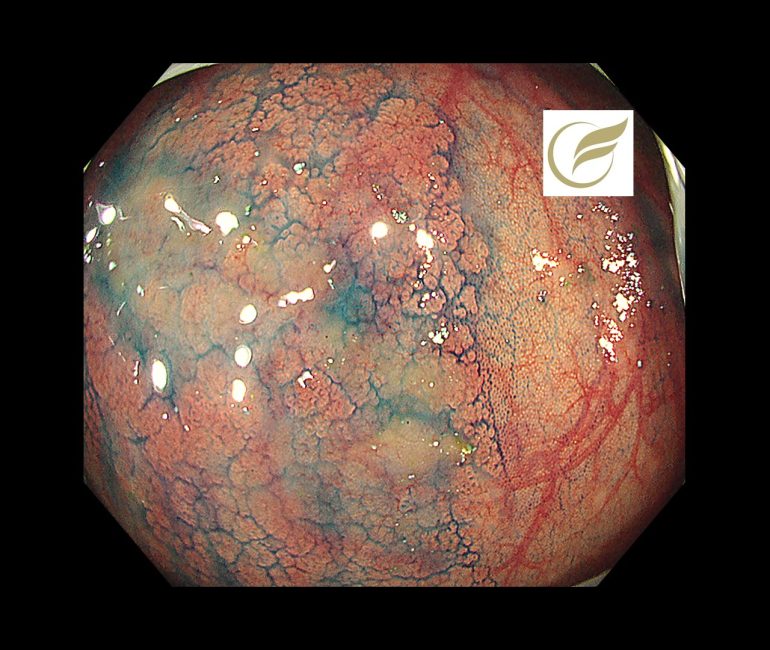
以下は当院で経験された胃MALTです。胃は全体的に萎縮を示し、体部では広範な褪色調粘膜と顆粒状の残存胃底腺粘膜がみられ、胃角部では多発びらんを伴っており、多点生検により胃MALTと診断されました。
文責 院長 岡田和久
(参考文献)
(1)Isaacson PG, Wright DH. Malignant lymphoma of mucosa-associated lymphoid tissue: a distinctive type of B-cell lymphoma.
Cancer. 1983; 52(8): 1410–1416.
(2)Wotherspoon AC, Ortiz-Hidalgo C, Falzon MR, Isaacson PG. Helicobacter pylori-associated gastritis and primary B-cell gastric lymphoma.
Lancet. 1991; 338(8776): 1175–1176.
(3)Nakamura S, Yao T, Aoyagi K, et al. Helicobacter pylori and primary gastric lymphoma: a histopathologic and immunohistochemical analysis of 237 patients.
Cancer. 1997; 79(1): 3–11.
(4)Zucca E, Roggero E, Bertoni F, Cavalli F. Primary extranodal non-Hodgkin’s lymphomas. Part 1: Gastrointestinal, cutaneous and genitourinary lymphomas.
Ann Oncol. 1997; 8(8): 727–737.
(5)Zullo A, Hassan C, Cristofari F, et al. Effects of Helicobacter pylori eradication on early stage gastric mucosa-associated lymphoid tissue lymphoma.
Clin Gastroenterol Hepatol. 2010; 8(2): 105–110.
(6)Zucca E, Bertoni F. Gastric marginal zone lymphoma of MALT type: ESMO clinical practice guidelines.
Ann Oncol. 2013; 24(Suppl 6): vi144–vi148.
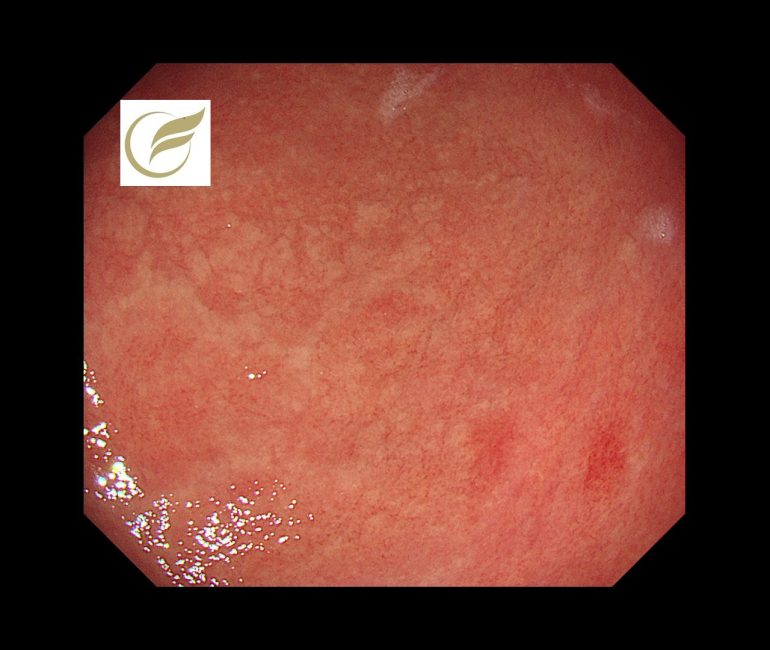
汎胃炎③/好酸球性胃腸炎②(胃内視鏡/胃カメラ)
二次性好酸球性胃腸炎は、特定の原因により消化管に好酸球浸潤を来す状態をいい(1)(2)、原因として、食品(プロテイン・特定食物)、薬剤、寄生虫感染、アレルギー疾患、全身性疾患などが知られています(2)(3)。
一次性については、以下もご参照ください。https://www.jiyugaoka-gc.com/medicalinformation/gastroscope/2317/
症状は腹痛、下痢、嘔吐など非特異的で一次性と区別しがたく(4)、病理学的にも一次性と同様に好酸球浸潤を認めますが、形態的な差は乏しいとされています(5)。
内視鏡所見は非特異的で、発赤、浮腫、顆粒状粘膜、びらん、潰瘍などがみられます(4)(7)(8)。
病変は限局せず、びまん性あるいは多発性に分布することが多く(7)、肉眼的に正常に見える粘膜から好酸球浸潤が検出されることもあります(8)。
また内視鏡像のみで、他疾患あるいは一次・二次とを鑑別することは困難で、外観に関わらず多点生検が重要です(4)(9)。
治療は、原因物質の除去や基礎疾患の治療が基本となり、診断の本質も原因検索とその除外・中止により症状や病理所見が改善するかどうかにあります(1)(6)(10)。
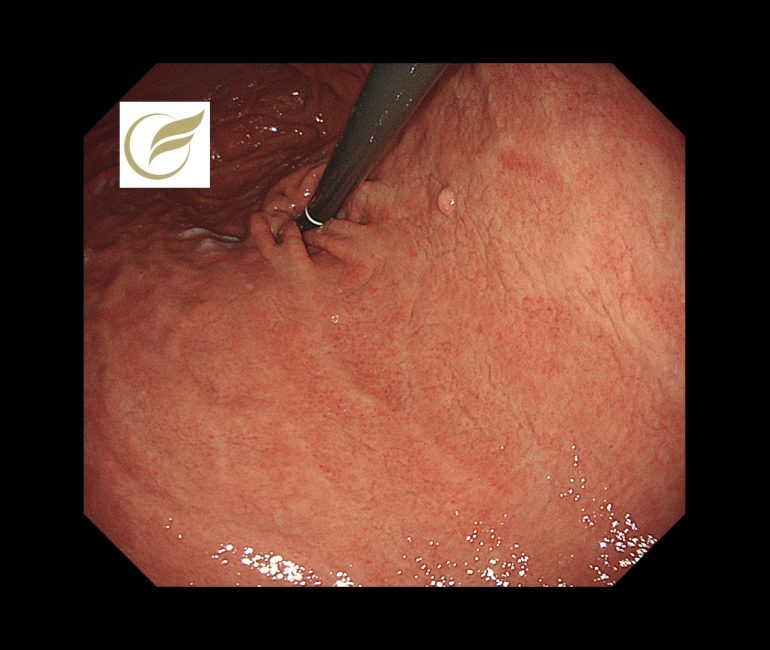
以下の症例は、生検で好酸球浸潤(平均100/HPF以上)が確認され、プロテイン内服による好酸球性胃炎様変化(二次性)疑いとなり、プロテイン中止により速やかに症状(腹痛・嘔吐など)が消失した症例です。前庭部の複数の白色調の細顆粒状~粒状隆起、網目状のひび割れ所見(11)に類似した所見を認めました。
(1)Klein NC, et al. Eosinophilic gastroenteritis. Medicine (Baltimore). 1970;49:299–319.
(2)Rothenberg ME. Eosinophilic gastrointestinal disorders. J Allergy Clin Immunol. 2004;113:11–28.
(3)Lucendo AJ. Eosinophilic diseases of the gastrointestinal tract. Scand J Gastroenterol. 2010;45:1013–1021.
(4)Talley NJ, et al. Eosinophilic gastroenteritis: a clinicopathological study. Gastroenterology. 1990;99:1762–1770.
(5)Dellon ES, et al. Diagnostic criteria for eosinophilic gastrointestinal disorders. J Allergy Clin Immunol. 2013;131:1355–1363.
(6)Pesek RD, et al. Eosinophilic gastrointestinal diseases. Ann Allergy Asthma Immunol. 2014;113:1–9.
(7)Zhang M, et al. Endoscopic features of eosinophilic gastroenteritis. Endoscopy. 2019;51:477–485.
(8)Ingle SB, et al. Eosinophilic gastroenteritis: an unusual type of gastroenteritis. World J Gastroenterol. 2013;19:5061–5066.
(9)Ko HM, et al. Eosinophilic gastritis and enteritis. Arch Pathol Lab Med. 2014;138:1310–1318.
(10)Lucendo AJ, et al. Treatment of eosinophilic gastroenteritis. Curr Opin Gastroenterol. 2017;33:442–447.
(11)Fujiwara Y, et al : Endoscopic findings of gastric lesions in patients with eosinophilic gastrointestinal disorders.Endosc Int Open 8 : E1817―E1825, 2020.
文責 院長 岡田和久
除菌後胃癌(胃内視鏡/胃カメラ)
除菌後胃癌は、Helicobacter pylori 除菌が成功した後に発見される胃癌をいいます(1)(2)。
日本の胃がん死亡者数は徐々に漸減傾向ですが、いまだ年約4万人が罹患し、がん死亡者数の第 3 位を占めています。除菌後に定期的な内視鏡検査を実施しているにも関わらず、進行胃癌で発見される症例もあり、除菌後の早期胃癌の内視鏡診断は難しいとされています。
その理由のひとつに、除菌後においては背景胃粘膜の炎症が改善することで、病変と周囲粘膜との色調の差が乏しくなり発見が難しくなることがあるため(1)(4)、ときに病変が周囲粘膜に自然に溶け込むように存在し、病変と正常粘膜の境界が不明瞭となってしまうことがあげられます(4)(5)。さらに肉眼的な形態について、平坦型やごく浅い陥凹型が多く、明らかな隆起を示しにくくなる傾向があり(3)(5)、病変径が小さい上にはっきりとした陥凹を呈することがないため、典型的な悪性所見に乏しい症例も多く経験されます(1)(3)(6)。背景に萎縮や腸上皮化生を伴うことで、粘膜模様が均一化し、病変の認識がさらに難しくなることも、見逃されやすくなる原因である報告されています(4)(5)(7)。最近では、除菌後の背景粘膜が炎症軽減で均質化し病変が周囲に溶け込むような色調となった結果、除菌後胃癌が黄白色〜黄調に見えるようになるという色調・可視性に関する議論もされています(9)。除菌後症例においては、より丁寧な観察が重要となります(1)(2)(10)。
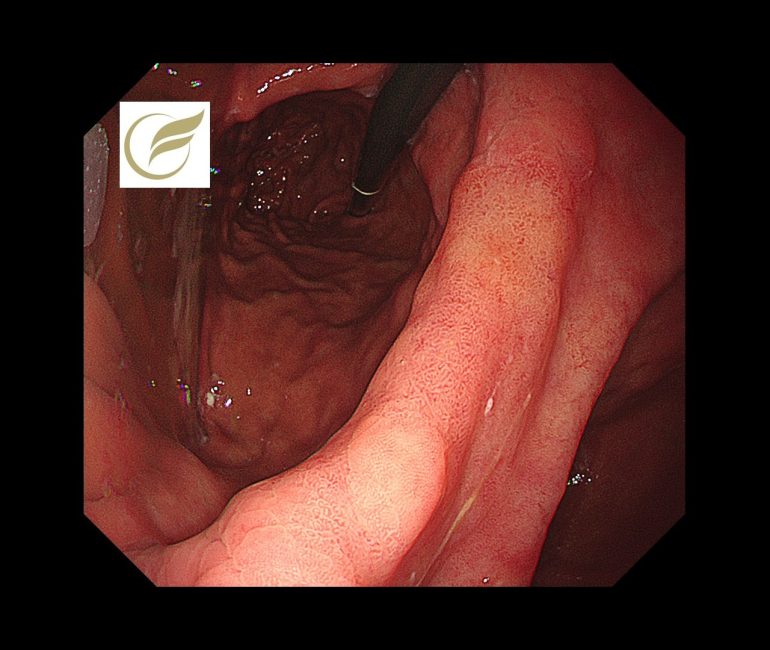
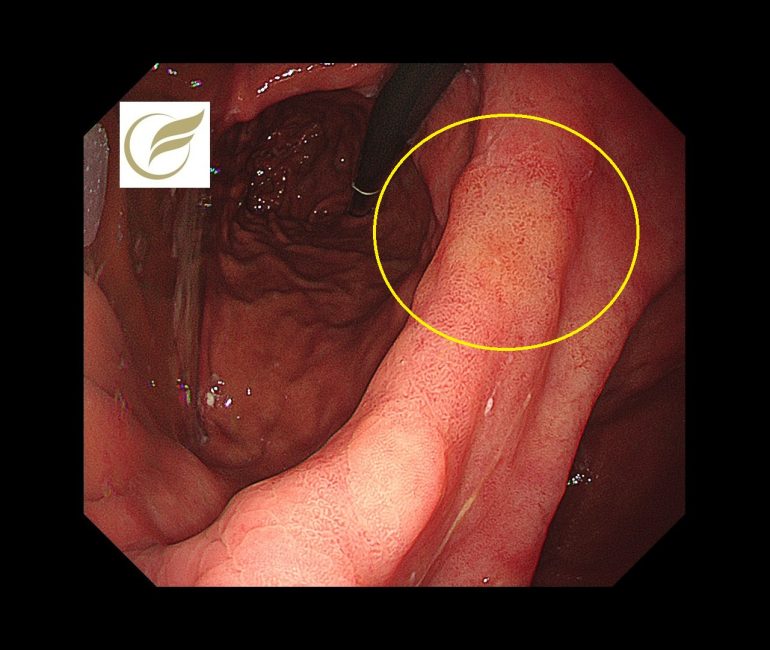
以下の病変は当院で経験された除菌後の早期胃癌(高分化型腺癌)の症例です。黄(白)色調に視認され、典型的な除菌後胃がんの特徴を示していました。
参考文献
(1)Uemura N, Okamoto S, Yamamoto S, et al. Helicobacter pylori infection and the development of gastric cancer. New England Journal of Medicine. 2001; 345(11): 784–789.
(2)Fukase K, Kato M, Kikuchi S, et al. Effect of eradication of Helicobacter pylori on incidence of metachronous gastric carcinoma after endoscopic resection of early gastric cancer: an open-label, randomized controlled trial. The Lancet. 2008; 372(9636): 392–397.
(3)Yamada M, Saito Y, Mori Y, et al. Characteristics of gastric cancer detected after Helicobacter pylori eradication. Gastric Cancer. 2016; 19(2): 468–476.
(4)Shichijo S, Hirata Y. Characteristics and management of gastric cancer after Helicobacter pylori eradication. World Journal of Gastroenterology. 2018; 24(20): 2163–2172.
(5)Kobayashi M, Hashimoto S, Nishikura K, et al. Endoscopic characteristics of gastric cancer after Helicobacter pylori eradication. Digestive Endoscopy. 2013; 25(5): 503–510.
(6)Matsuo T, Ito M, Takata S, et al. Clinicopathological features of early gastric cancer detected after Helicobacter pylori eradication. Digestion. 2012; 85(4): 279–285.
(7)Muto M, Yao K, Kaise M, et al. Magnifying endoscopy with narrow-band imaging for diagnosis of gastric cancer: a prospective multicenter study. Endoscopy. 2009; 41(7): 583–589.
(8)Pimentel-Nunes P, Libânio D, Lage J, et al. Endoscopic diagnosis of gastric lesions after Helicobacter pylori eradication. Endoscopy. 2016; 48(6): 527–536.
(9) Li H, Zhang Z, Wang W, et al. Endoscopic characteristics and high-risk background mucosal factors of early gastric cancer after Helicobacter pylori eradication.
Frontiers in Oncology. 2023; 13:1272187. doi:10.3389/fonc.2023.1272187.
(10)Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2021 (6th edition). Gastric Cancer. 2023; 26(1): 1–25.
大腸SSL(大腸内視鏡/大腸カメラ)
大腸SSL(Sessile Serrated Lesion:無茎性鋸歯状病変)は、大腸がんの前がん病変として近年重要視されており(1)、
従来の腺腫とは異なり、「鋸歯状経路」と呼ばれる別の発がん経路をとり(2)、特に右側結腸に多く発生するという特徴を持ちます(1)(3)。
形態は、平坦あるいはごく低い隆起を示し、ポリープのような隆起を呈しなかったり、表面に粘液が付着していたりすることが多いとされています(4)。
病理学的には、腺管底部の拡張やL字・逆T字型の鋸歯状構造を示します(1)(5)。
遺伝子の変異としては、BRAF変異という変異が高頻度に認められ(2)(6)、さらにDNAメチル化異常(CIMP)が強く関与します(3)。
これらの分子異常により、通常の腺腫より急速にがん化する例があるともされており(6)(7)、10mm以上のSSLでは将来的ながん化リスクが有意に高まるため(4)(8)、特に異形成を伴う場合には切除することが強く推奨されています(1)(8)(9)。
一方で、前記したように病変は平坦で存在感に乏しいうえに、周囲粘膜との色調差がつきにくいという特徴があるため(4)、病変自体の広がりも分かりにくく、発見も切除範囲の判断も難しい場合があり(10)、通常の白色光内視鏡では見逃されやすいと報告されています(3)(11)。
このような視認性の悪さが、SSLの検出率低下につながっているため(11)(12)、観察時間の確保と丁寧な洗浄が、検出率向上に重要とされています(8)(12)。
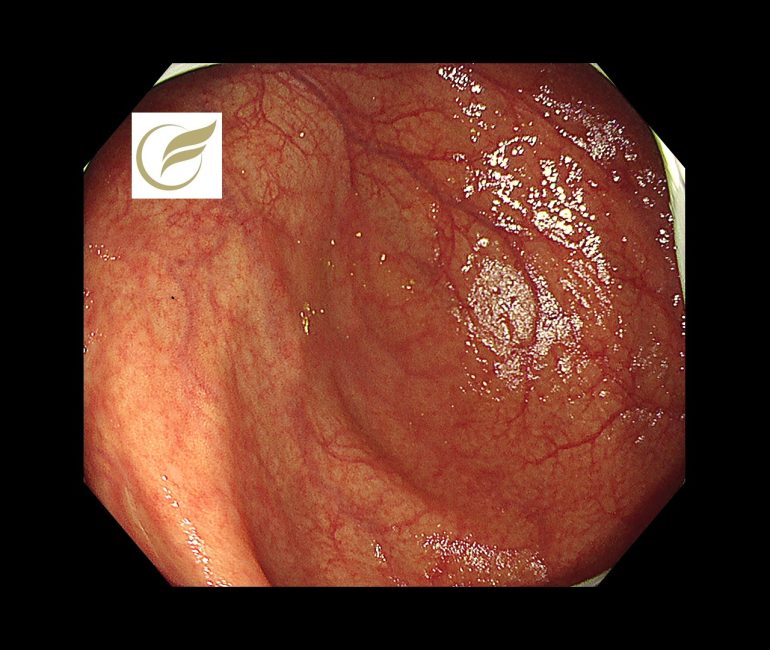
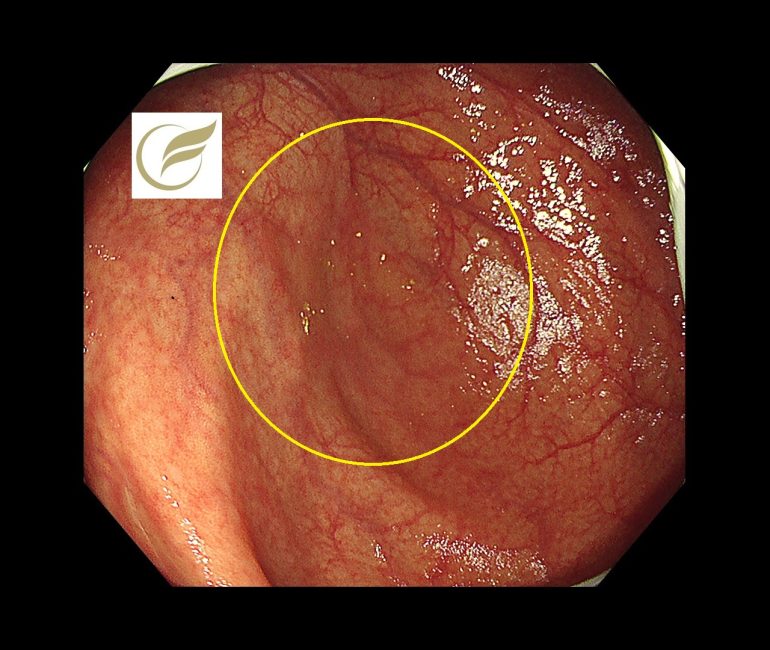
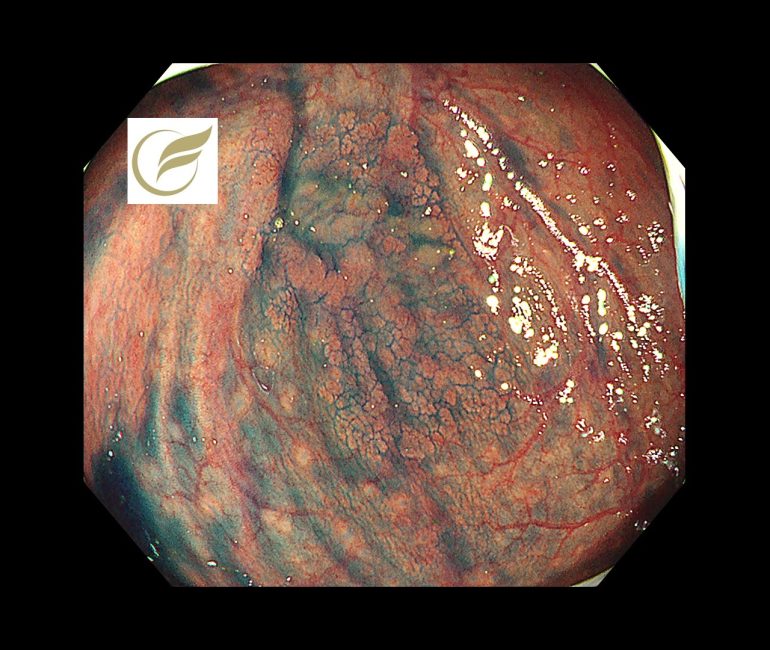
以下の病変は盲腸の15mm大の病変で、比較的視認性が悪い病変となっています。
引用文献
(1)WHO Classification of Tumours Editorial Board. Digestive System Tumours, 5th ed. IARC, 2019.
(2)Leggett B, Whitehall V. Role of the serrated pathway in colorectal cancer pathogenesis. Gastroenterology. 2010.
(3)Rex DK, et al. Serrated lesions of the colorectum. Gastroenterology. 2012.
(4)東正新ほか.大腸鋸歯状病変の内視鏡診断.胃と腸. 2018.
(5)Torres C, et al. Serrated colorectal lesions: classification and clinical relevance. World J Gastroenterol. 2015.
(6)Iino H, et al. BRAF mutation and CIMP in SSL. Gut. 2014.
(7)Bettington M, et al. Serrated pathway colorectal cancer. Pathology. 2013.
(8)日本消化器内視鏡学会.大腸ポリープ診療ガイドライン.2020.
(9)Torlakovic E, et al. Sessile serrated adenoma with dysplasia. Am J Surg Pathol. 2008.
(10)Hayashi N, et al. Endoscopic resection of SSL. Endoscopy. 2019.
(11)East JE, et al. Serrated lesion detection. Gut. 2015.
(12)Kahi CJ, et al. Colonoscopy quality and serrated polyps. Clin Gastroenterol Hepatol. 2014.
Double pylorus(胃内視鏡/胃カメラ)
-
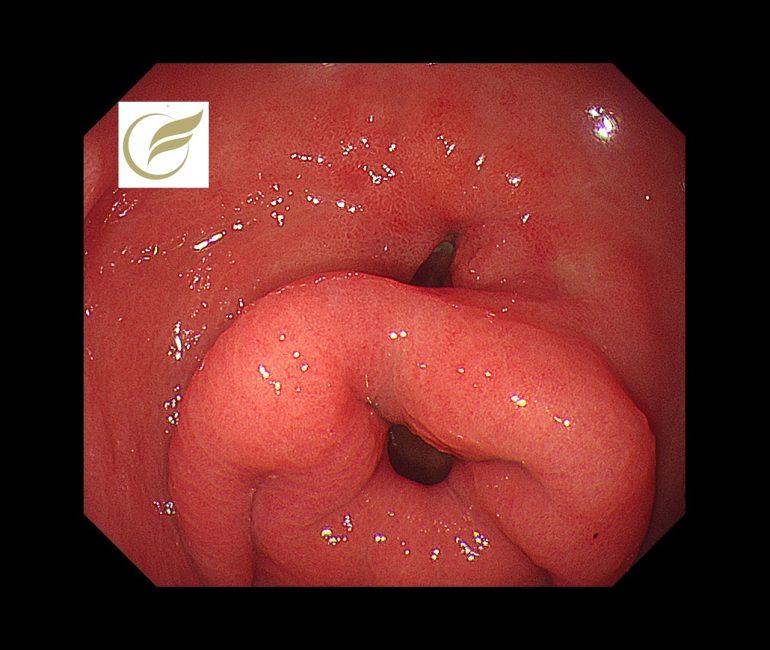
二重幽門は、胃の幽門部から十二指腸球部への副経路が存在するまれな内視鏡所見をいいます。
-
主には胃と十二指腸の間に形成された瘻孔(fistula)により、上部消化管内視鏡検査の中で、0.001% ~ 0.4%という非常に稀な割合で報告されています(1)。
-
先天性と後天性に分類され、先天性は発生期における管腔の異常形成によるもので、通路間の組織が正常で潰瘍病変がないのが特徴とされ、多くは無症状で偶然発見されており、特に治療は不要とされています(2)。
-
後天性は先天性よりも頻度が高く、胃潰瘍や十二指腸潰瘍が進行した結果、胃と十二指腸球部の壁が癒着して瘻孔が形成されるものをいい、NSAIDsやステロイドの使用、Helicobacter pylori(ピロリ菌)感染、糖尿病、慢性呼吸器疾患、SLE、腎不全、ベーチェット病など、潰瘍治癒遅延を引き起こしやすい病態が関連していると報告されています(3、4、5)。
- 後天性も発見時には無症状のことが多く、穿孔・出血などがなければ、病態に応じてピロリ除菌や原因薬剤の中止、酸分泌抑制薬の投与などで経過をみることになります。後天性の自然経過についての後ろ向き追跡調査によれば、酸分泌抑制薬で治療を受けた場合においても瘻孔は大多数(64%)で開存したままで、27%が中隔が消失して正常幽門と癒合し、閉鎖された例はわずか9%だったとされています(3)。
-
内視鏡治療や薬物治療が無効な場合、あるいは合併症(出血、穿孔、胆汁逆流など)がある場合には、手術が検討されます。
以下は当院で経験されたピロリ陽性例での二重幽門の症例です。
(1)Wiseman SM, Tan D, Hill HC. Double pylorus: an unusual endoscopic finding. Endoscopy. 2005;37:277. [RCA] [PubMed] [DOI] [Full Text] Lei JJ, Zhou L, Liu Q, Xu CF. Acquired double pylorus: Clinical and endoscopic characteristics and four-year follow-up observations. World J Gastroenterol 2016; 22(6): 2153-2158 [PMID: 26877621 DOI: 10.3748/wjg.v22.i6.2153]
(2)Wolters VM, Nikkels PG, Van Der Zee DC, Kramer PP, De Schryver JE, Reijnen IG, Houwen RH. A gastric diverticulum containing pancreatic tissue and presenting as congenital double pylorus: case report and review of the literature. J Pediatr Gastroenterol Nutr. 2001;33:89-91. Lei JJ, Zhou L, Liu Q, Xu CF. Acquired double pylorus: Clinical and endoscopic characteristics and four-year follow-up observations. World J Gastroenterol 2016; 22(6): 2153-2158 [PMID: 26877621 DOI: 10.3748/wjg.v22.i6.2153]
(3)Hu TH, Tai DI, Changchien CS, Chen TY, Chang WC. Double pylorus: report of a longitudinal follow-up in two refractory cases with underlying diseases. Am J Gastroenterol. 1995;90:815-818. [PubMed] [DOI]
(4) Fattahi MR, Homayoon K, Hamidpour L. Double pylorus in a cirrhotic patient: a case report and review of the literature. Middle East J Dig Dis. 2012;4:130-132. [PubMed] 18. Costa S, Dias VC, Peixoto P, Machado A, Gonçalves R. Double pylorus. Rev Esp Enferm Dig. 2015;107:377. [PubMed]
(5)Lei JJ, Zhou L, Liu Q, Xu CF. Acquired double pylorus: Clinical and endoscopic characteristics and four-year follow-up observations. World J Gastroenterol 2016; 22(6): 2153-2158 [PMID: 26877621 DOI: 10.3748/wjg.v22.i6.2153]
文責 院長 岡田和久
LAMN(大腸内視鏡/大腸カメラ)
虫垂粘液嚢腫は、虫垂根部が炎症や腫瘍により閉塞することで、貯留した粘液により虫垂の内腔が嚢状に拡張して形成されるもので、虫垂切除例の0.04-4.19%と比較的稀な疾患です。
これらはWHO分類において、明らかな腫瘍成分を伴うMACA(mucinous adenocarcinoma)と、それ以外のLAMN(low-grade appendiceal neoplasm:低異型度粘液性腫瘍)に分類されます(1)。
LAMNは、虫垂外へ病変が波及すると腹膜偽粘液腫となる進行性の腫瘍であるため、悪性腫瘍として取り扱われており、治療は外科手術が原則となります(2)。
腹膜偽粘液腫は、腹膜偽粘液腫は悪性度の低い癌性腹膜炎の一種と考えられ、根治が難しい疾患ですが、
術後病理がLAMN TisN0M0(Stage0)の症例においても腹膜播種再発をきたした症例が報告されており、慎重な取り扱いや経過観察が必要とされています(3)。
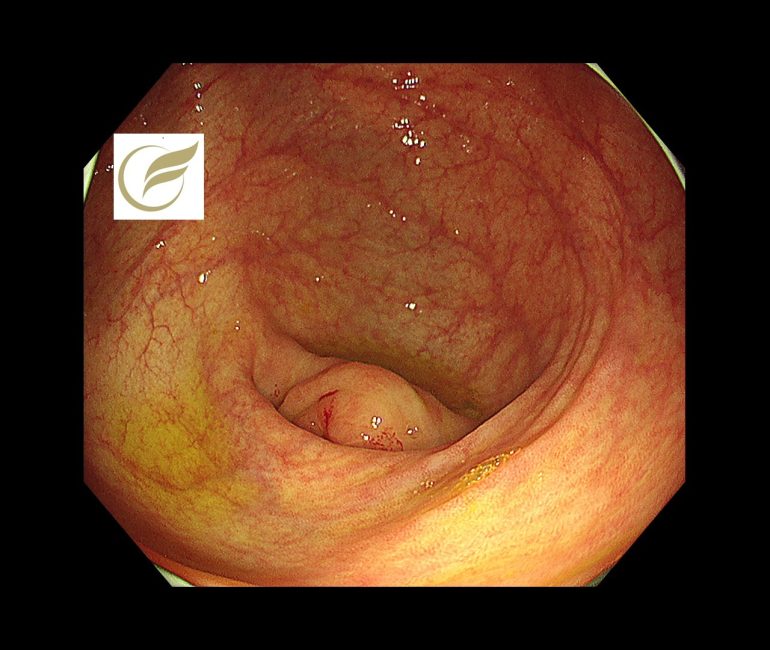
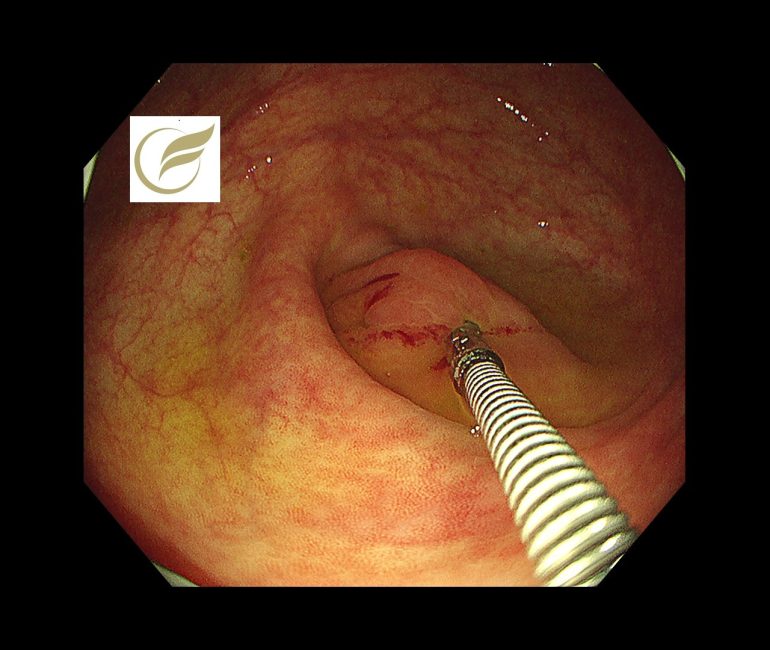
LAMNの症例の中には、急性虫垂炎として治療され、術後にLAMNと診断されたり、大腸内視鏡検査において必ずしも異常所見を示さない例があり、診断が困難な例があります。
以下の症例では、虫垂開口部付近の粘膜下腫瘍様の隆起により発見でき、外科手術が施行され、術後病理でLAMNの診断となりました。
参考文献
(1)Misdraji J: Appendiceal mucinous neoplasm. WHO Classification of Tumours Editorial Board. WHO Classification of Tumours. Digestive System Tumours, 5th Ed. International Agency for Research on Cancer, Lyon, p144-146, 2019
(2)大腸癌研究会編:大腸癌取扱い規約.第8版,金原出版,東京,2013,p54-61
文責 院長 岡田和久
AIN(大腸内視鏡/大腸カメラ)
肛門管上皮内腫瘍(anal intraepithelial neoplasia:AIN)は、肛門管扁平上皮から移行上皮にかけて発生する比較的稀な腫瘍の総称で、肛門扁平上皮癌の前駆病変とされています。
主としてヒトパピローマウイルス(HPV)が発生に関与するとされ、高リスク型のHPV感染により異型上皮が発生した後、上皮内癌,進行癌へと進展していきますが 、肛門管扁平上皮癌側からみると9割がHPV陽性であるとの報告もあります1.2)。
内視鏡像は隆起型が多く、他に乳頭状、鶏冠状、扁平隆起型などがあり、ルゴール染色では不染帯を呈します。
Narrow band imaging(NBI拡大観察)では、食道異形上皮に類似したドット状・ループ状血管、分布不均一なIPCL(intraepitherial papillary capillary loop)様血管などを示し、範囲や深度の決定に有用である可能性が示唆されています3.4.5)
病理組織診断では、p16やKi67の免疫染色が有用で、p16は高リスク型のHPVに関連した病変で高率に発現し、免疫染色ではhigh grade AINの70〜100%でびまん性に強陽性を示すと報告されていて6)、
WHO分類5版においても、p16染色でブロックパターンに染色されるAIN2/AIN3は、浸潤癌に移行する可能性が高いhigh-grade squamous intraepithelial neoplasia(HSIL)に分類されており、治療対象となります7)。
治療法については、アブレーション、EMR、ESD、トリクロロ酢酸外用、イミキモド外用、フルオロウラシル外用などが有効との報告があり、治療介入により発がん率の抑制効果が示唆されています8)。
最近では、転移のリスクが非常に低いと考えられている上皮内癌やAINに対する内視鏡的治療アプローチが可能になっています9-12)。
以下は当院で発見されたAINで、小さな扁平隆起の病変と、広い平坦病変の2病変を合併した例です。生検診断で2病変ともAINの診断となりました。
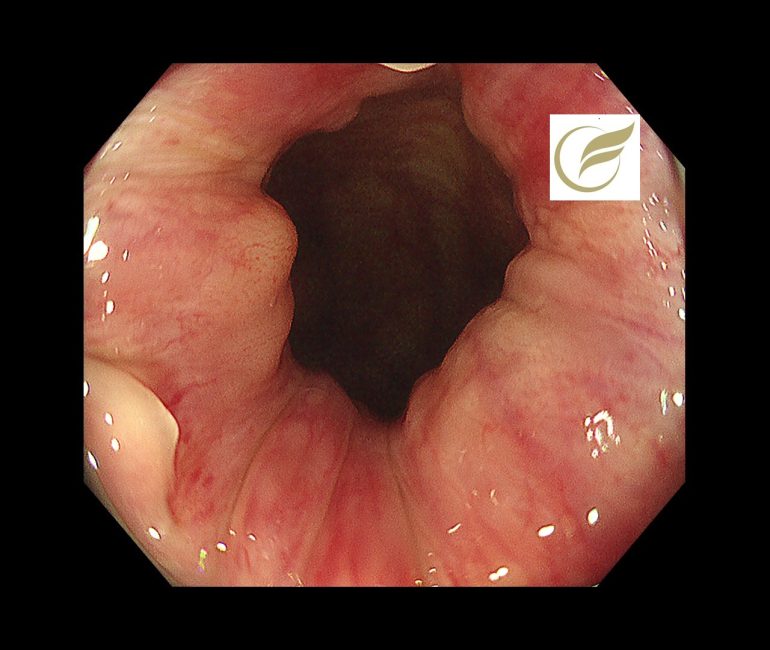
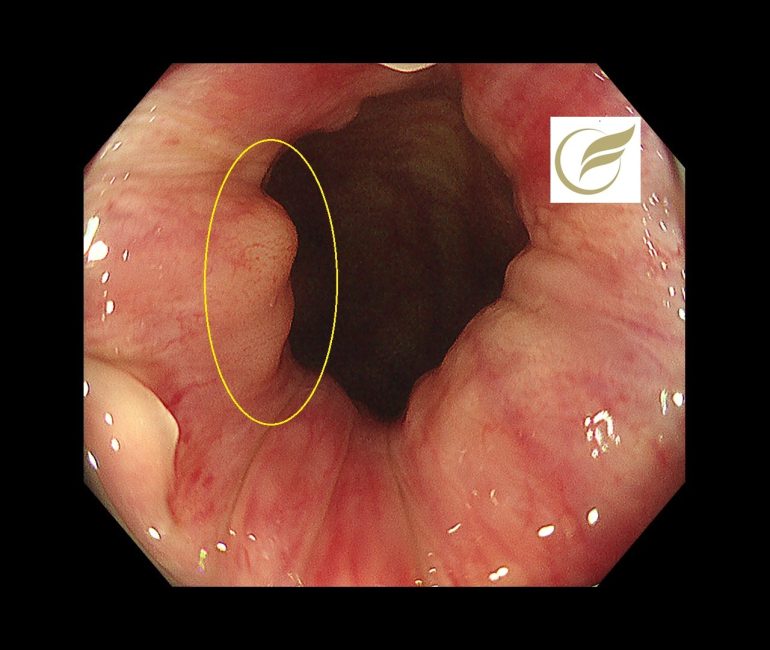
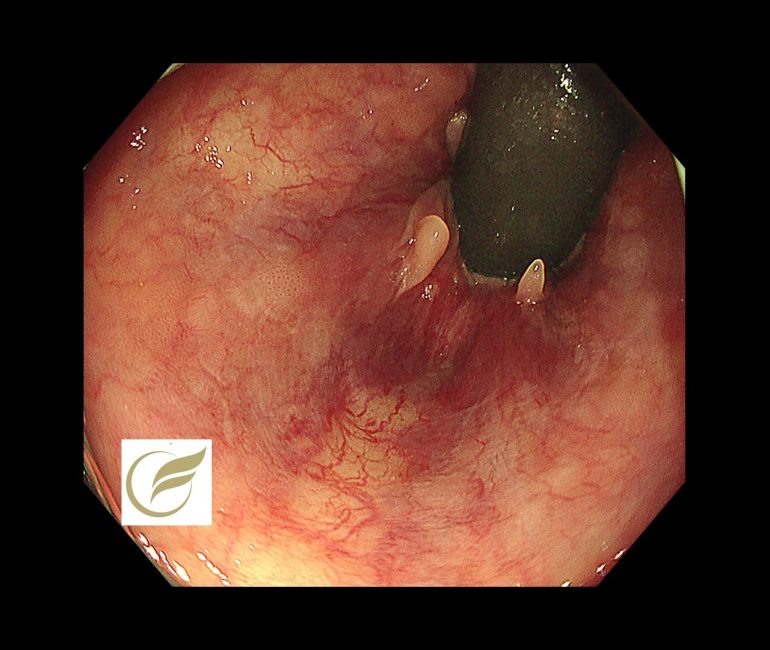
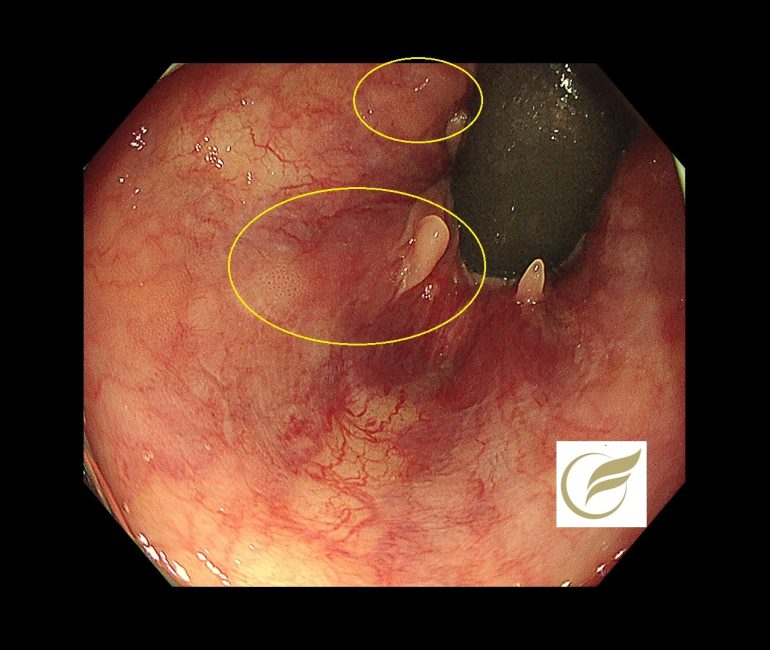
参考文献
- 1) Darragh TM, Colgan TJ, J Thomas Cox JT et al:The Lower Anogenital Squamous Terminology standarzation Project for HPV-Associated Lesions. Arch Pathol Lab
Med, 136:1266-1297,2012]
2) Muñoz N, Bosch FX, de Sanjosé N, et al:Epidermiologic classification of human papillomavirus types associated with cervical cancer. N Eng J Med, 348:518-27,2003
3) Kuwano H, Nishimura Y, Oyama T, et al. Guidelines for diagnosis and treatment of carcinoma of the esophagus April 2012 edited by the Japan Esophageal Society. Esophagus. 2015 Jan; 12(1): 1-30. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4) Ishihara R, Mizusawa J, Kushima R, et al. Assessment of the diagnostic performance of endoscopic ultrasonography after conventional endoscopy for the evaluation of esophageal squamous cell carcinoma invasion depth. JAMA Netw Open. 2021 Sep; 4(9): e2125317. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5) J Anus Rectum Colon. 2022 Apr 27;6(2):92-99. doi: 10.23922/jarc.2021-077. eCollection 2022. Anal Intraepithelial Neoplasia: Precursor of Anal Squamous Cell Carcinoma https://pmc.ncbi.nlm.nih.gov/articles/PMC9045852/
6) 高橋雅恵,堀口慎一郎,山澤 翔,他:肛門部尖形コンジローマおよび高異型度肛門上皮内腫瘍の併存例.診断病理,32:136-140,2015
7) Darragh TM, Colgan TJ, Cox JT, et al. The Lower Anogenital Squamous Terminology Standardization Project for HPV-Associated Lesions: background and consensus recommendations from the College of American Pathologists and the American Society for Colposcopy and Cervical Pathology. Arch Pathol Lab Med. 2012 Oct; 136(10): 1266-97. [DOI] [PubMed] [Google Scholar]
8) N Engl J Med . 2022 Jun 16;386(24):2273-2282. doi: 10.1056/NEJMoa2201048. Treatment of Anal High-Grade Squamous Intraepithelial Lesions to Prevent Anal Cancer https://pubmed.ncbi.nlm.nih.gov/35704479/
9)Chou YP, Saito Y, Matsuda T, et al. Novel diagnostic methods for early-stage squamous cell carcinoma of the anal canal successfully resected by endoscopic submucosal dissection. Endoscopy. 2009 Oct; 41(Suppl 2): E283-5. [DOI] [PubMed] [Google Scholar]
- 10) Oono Y, Fu K, Nakamura H, et al. Narrowband imaging colonoscopy with a transparent hood for diagnosis of a squamous cell carcinoma in situ in the anal canal. Endoscopy. 2010 Dec; 42(Suppl 2): E183-4. [DOI] [PubMed] [Google Scholar]
- 11) Kasuga K, Saito Y, Wu SYS, et al. Impact of endoscopic submucosal dissection of an anal squamous intraepithelial lesion with indistinct border. Endoscopy. 2020 Feb; 52(2): E75-7. [DOI] [PubMed] [Google Scholar]
12)Clinical application of endoscopic submucosal dissection for superficially invasive squamous cell carcinoma/high-grade squamous intraepithelial lesion involving the canal anal. Tech Coloproctol. 2024 Jul 31;28(1):90. doi: 10.1007/s10151-024-02966-8.PMID: 39085740
文責 院長 岡田和久
胃悪性リンパ腫(ピロリ陰性)⑤(胃カメラ/胃内視鏡)
MALTリンパ腫はリンパ濾胞のmarginal zoneからのmucosa-associated lymphoid tissu由来であり、B細胞リンパ腫の一種です。
さまざまな肉眼的形態を示し、早期胃癌類似型、胃炎類似型、隆起型などに大別されますが(1)、
本例のような陥凹限局型の胃MALTでは、内視鏡的に未分化型の早期癌との鑑別が問題になります。
H.pylori感染が認められる場合には除菌治療が第一選択となり、80%程度が完全寛解しますが、除菌治療が奏功しない場合やH.pylori未感染の場合には、
限局期(stageIないしIIa)であれば低線量放射線治療が有効です(2)。
他方でH.pylori未感染であっても除菌治療が有用な例が報告されており、その中にはH.heilmanniiなどのNHPHが関与している可能性を考慮する必要があります(4)。
本例ではH.pylori未感染に発生した3-4mm大の退色調の陥凹性病変で、生検でMALTの診断となり、放射線治療が施行されました。
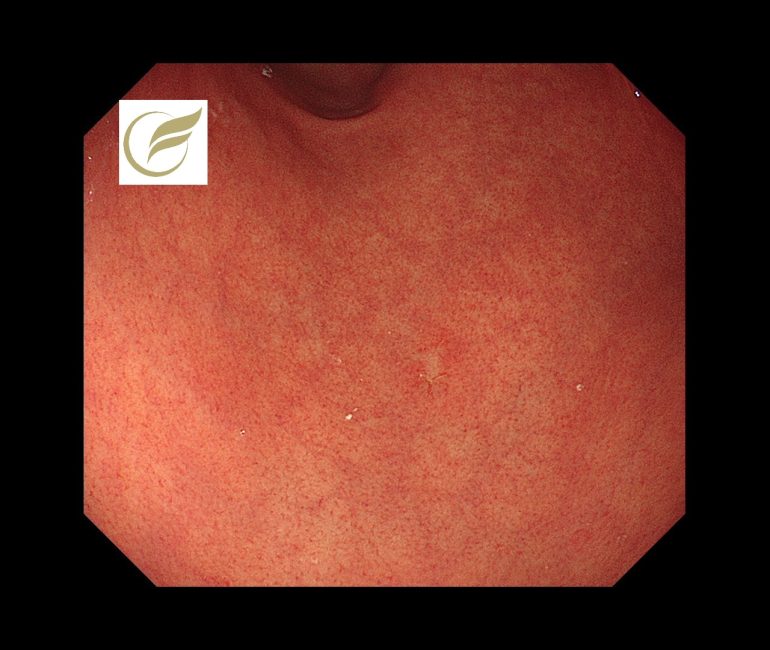
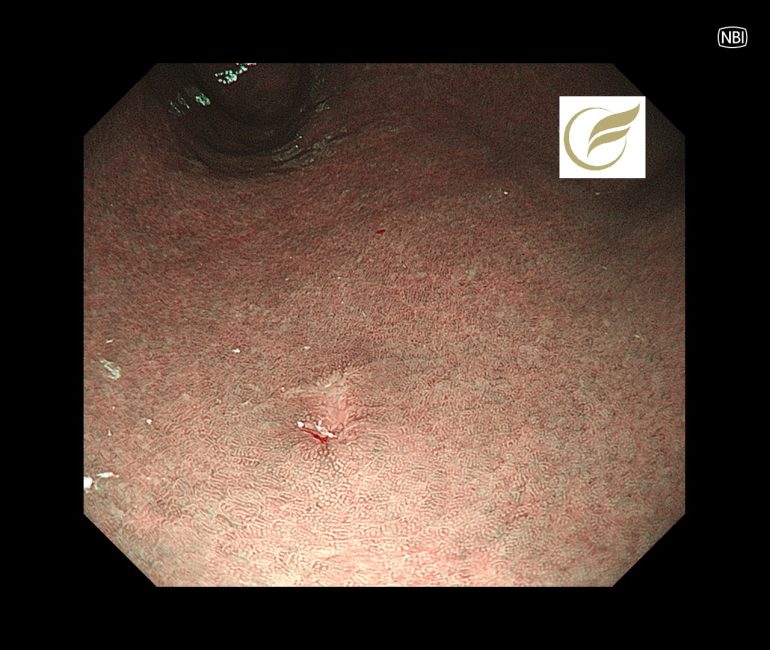
参考症例①
Comparison of localized gastric mucosa-associated lymphoid tissue (MALT) lymphoma with and without Helicobacter pylori infection
Taiji Akamatsu et al. PMID: 16579838
Long-term clinical outcome of gastric MALT lymphoma after eradication of Helicobacter pylori: a multicentre cohort follow-up study of 420 patients in Japan
Shotaro Nakamura et al. PMID: 21890816 DOI: 10.1136/
SuSA①(大腸内視鏡/大腸カメラ)
Superficially serrated adenoma(SuSA)は比較的稀な、S状結腸から直腸に局在する、褪色または正色調の無茎性または平坦型の病変で、既存のWHO分類などでは分類が困難なものとして報告されました(1)。
KRAS変異およびRSPO融合/過剰発現などの遺伝子異常を伴っていて、traditional serrated adenoma(TSA)の前駆病変と考えられています(1,2)。
sessile serrated lesionとの鑑別は、局在や、内視鏡所見(分葉状で、mucosal capがない)が参考になりますが、
hyperplastic polyp(HP)とは内視鏡所見としての類似点が多く、病変のサイズが小さいものでは内視鏡的にHPと判断されてしまい、HPとして経過観察されている微小病変のなかの一部にSuSAが含まれている可能性が示唆されています(3)。
SuSAから直接浸潤癌へ進展した例の報告もあるため(4)、SuSAと診断された病変は治療が必要となります。
以下は当院で経験された症例で、切除後病理でSuSAと診断されたものです。
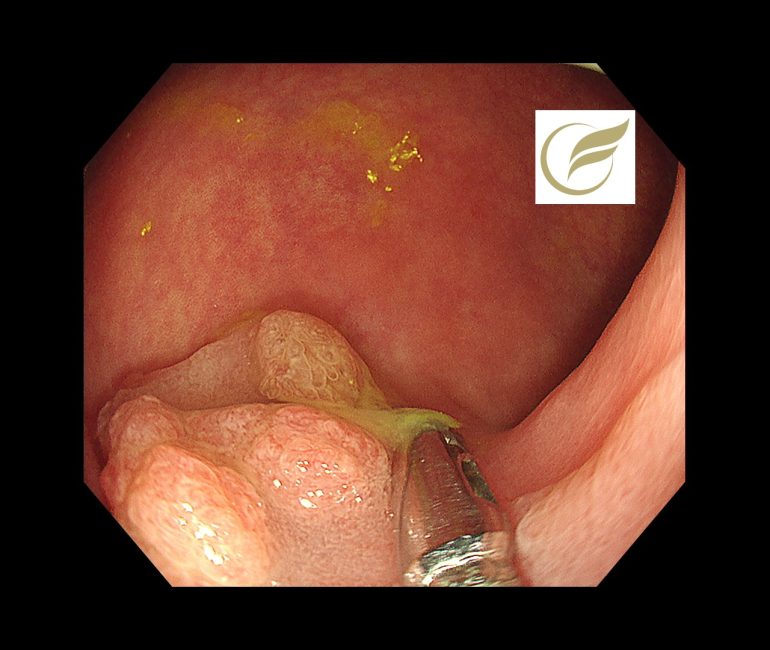
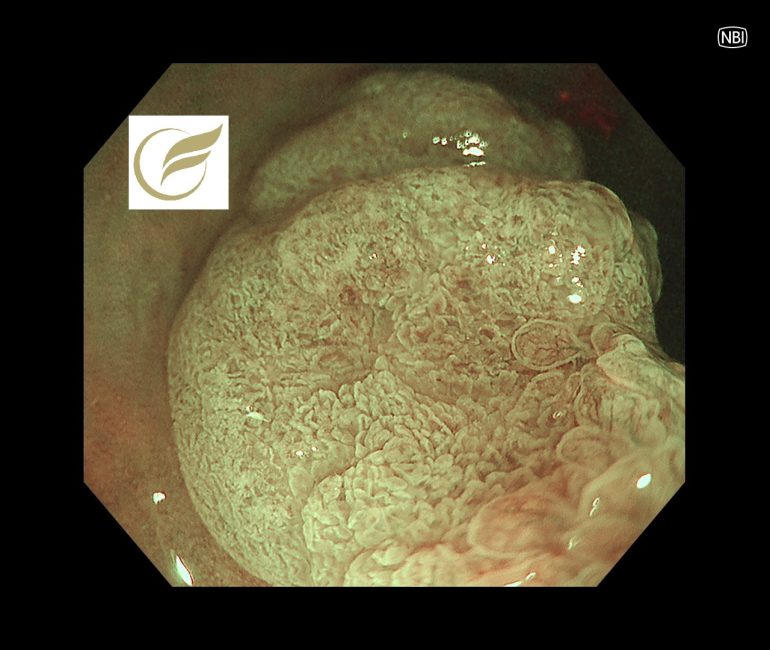
参考文献
(1)Superficially serrated adenoma: a proposal for a novel subtype of colorectal serrated lesion.
. 2018 Oct;31(10):1588-1598. doi: 10.1038/s41379-018-0069-8. Epub 2018 May 22.PMID: 29789649
Identification of a novel PRR15L-RSPO2 fusion transcript in a sigmoid colon cancer derived from superficially serrated adenoma.
文責 院長 岡田和久
十二指腸GIST③(胃内視鏡/胃カメラ)
GISTは中胚葉由来の消化管間葉系腫瘍であり、消化管固有筋層にあるCajal介在細胞(消化管内の食物を運ぶ働きに関係している神経細胞)から発生した腫瘍と考えられています。
小さいうちには症状はなく、検査で偶発的に見つかることが多いのですが、増大にしたがって出血、腹痛、腫瘤蝕知などを認め、発見にいたることもあります。
GISTの好発部位は胃が60%、小腸が30%、大腸5%、食道5%といわれており、十二指腸は全体の3-5%とされています(1-4)。
十二指腸のうち、下行部、水平部・上行部・球部の順に多いとの報告もあります。
GISTは悪性化する潜在性がある腫瘍であり、GIST診療ガイドラインで、治療の第一選択は基本的に外科切除とされています(5)。
以下は当院で経験された十二指腸下行脚の十二指腸GISTです。症状はありませんでした。
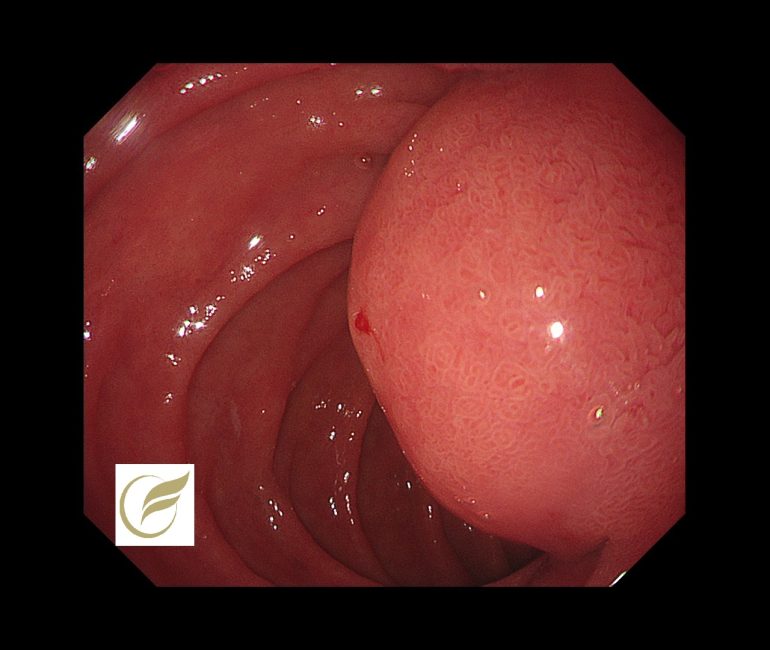
参考症例
参考文献
(1)消化器内視鏡Vol35 No4 2024 P522-523
(2)臨床と研究96 P843-847 2019
(3)臨床外科74 P889-892 2019
(4)Gastrointestinal stromal tumors: pathology and prognosis at different sites.
(5)日本癌治療学会 GIST診療ガイドライン 2022年4月改定第4版 http://www.jsco-cpg.jp/gist/
文責 院長 岡田和久